Notícias e Eventos da OM
AGENDA DE EVENTOS
ACONTECE NA FAB
EXPOSIÇÃO

Caça F-39 Gripen da Força Aérea está exposto no Aeroporto de Brasília
A réplica em tamanho real do caça multimissão da Força Aérea Brasileira (FAB) ficará aberta à visitação de 18 de abril a 02 de maio, no Aeroporto Internacional
SAÚDE OPERACIONAL
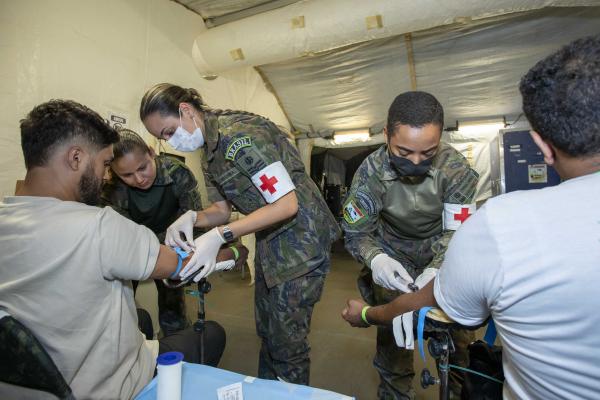
Hospital de Campanha da FAB supera 50 mil procedimentos no DF
A unidade de saúde foi instalada na região administrativa de Ceilândia (DF) para atender demandas de tratamento contra a dengue
BUSCA E SALVAMENTO

FAB realiza Evacuação Aeromédica em alto-mar
Foi utilizada uma aeronave H-36 Caracal, empregada pelo Primeiro Esquadrão do Oitavo Grupo de Aviação (1º/8º GAV) - Esquadrão Falcão
FAB TV
Assista à edição da revista FAB EM DESTAQUE
O FAB EM DESTAQUE desta sexta-feira (12/04) traz as principais notícias da Força Aérea Brasileira (FAB) de 5 a 11 de abril. Entre elas, o transporte de cinco órgãos pelo Primeiro Esquadrão de T ...


.jpg)










Redes Sociais